
引言
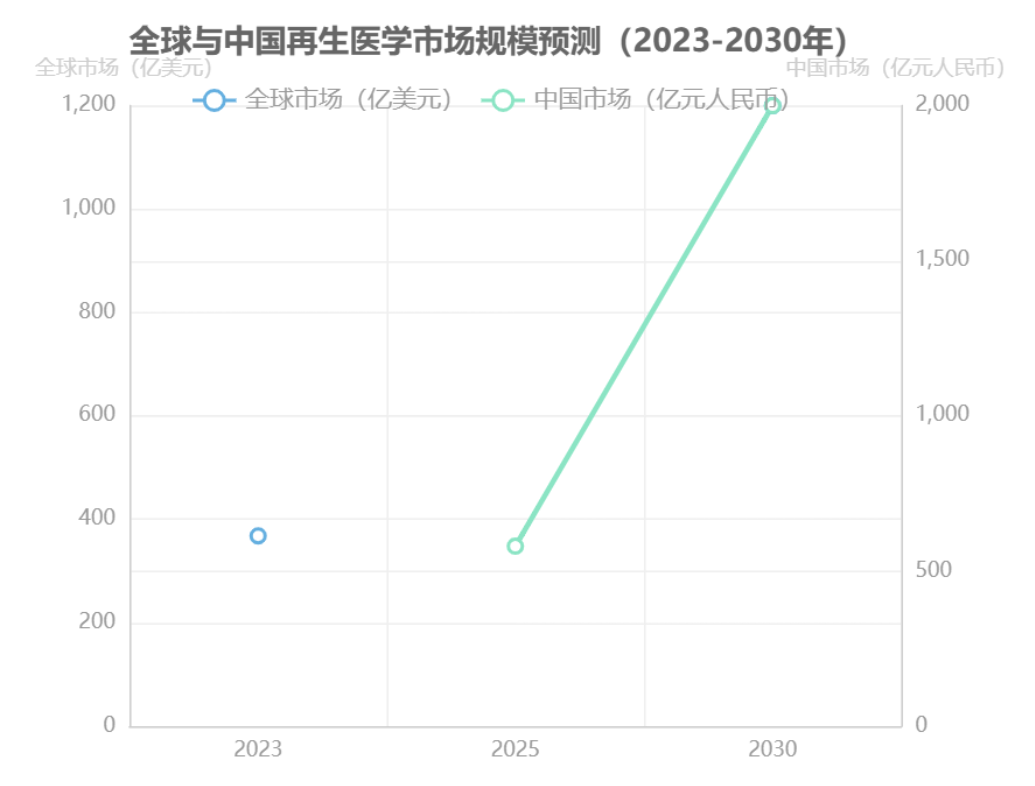
再生醫學作為繼藥物治療和手術治療之后的“第三次醫學革命”,正以年均復合增長率15%-25%的態勢重塑全球醫療產業格局。根據弗若斯特沙利文數據,2023年全球市場規模達368億美元,預計2030年突破1200億美元,其中亞太地區增速領先(CAGR 25%),中國作為核心增長引擎,2025年市場規模預計達580億元,2030年將突破2000億元,CAGR高達23.6%。
技術發展路徑上,干細胞治療、基因編輯與組織工程構成三大支柱。中國在誘導多能干細胞(iPSC)領域實現突破:清華大學團隊利用iPSC技術培育功能性迷你肝臟完成動物試驗,鄧宏魁團隊開發的快速化學重編程體系將體細胞誘導時間縮短至10天,效率提升至38%。2025年1月,NMPA附條件批準首款間充質干細胞療法艾米邁托賽注射液上市,標志著中國再生醫學產業進入臨床轉化加速期。
核心定位:中國憑借政策支持、技術突破與市場潛力,正從亞太增長引擎向全球創新策源地轉型,其23.6%的市場增速顯著高于全球平均水平,為后續政策分析與產業戰略制定提供關鍵背景。
中國再生醫學政策導向
中國再生醫學政策體系以“政策驅動—監管優化—區域試點”為主線,形成國家戰略引領、全鏈條監管保障與區域創新實踐協同推進的發展格局。國家層面,《“十四五”生物經濟發展規劃》明確將再生醫學納入戰略性新興產業,近三年中央及地方財政累計投入研發資金超85億元,重點支持基因診療、干細胞與免疫細胞治療等前沿技術突破。政策演進呈現清晰路徑:從2009年衛生部將干細胞治療技術列為第三類醫療技術,到2025年創新實施“干細胞醫療技術”分類管理,政策框架逐步完善,為商業化落地提供制度保障。
在監管體系構建上,中國創新采用“雙軌制”模式,由藥監局與衛健委協同管轄,形成“全鏈條管控+漸進開放”特色。對比國際,中國審批效率已躋身全球前列,細胞基因治療產品(CGT)平均審評耗時372天,僅次于日本PMDA(368天),顯著快于美國FDA(404天)和歐盟EMA(533天)。技術監管層面,“細胞治療全生命周期區塊鏈云監工系統”實現從采集到回輸的數字化溯源,將質量事故追溯時間從28天壓縮至48小時,精準追責率達99.6%,體現監管科技賦能優勢。
區域試點成為政策落地的關鍵抓手。海南博鰲樂城國際醫療旅游先行區通過“先行先試”政策,率先破解“臨床研究不能收費”難題,已落地三項干細胞治療技術,定價分別為3.6萬元、6萬元和15萬元。云南、上海等地同步推進產業集群建設,如昆明高新區細胞產業集群創新園獲省級財政4000萬元專項資金支持,7家醫療機構通過國家干細胞臨床研究備案。這種“國家戰略+地方實踐”的協同模式,加速了技術轉化,2024年中國首款干細胞藥物艾米邁托賽注射液獲批上市,2025年IND申請受理量達39條,推動行業進入“技術+資本+制度”協同發展新階段。
政策關鍵節點
2009年:首次將干細胞治療列為第三類醫療技術
2021年:CAR-T產品國產化,治療成本下降41.7%(從120萬元降至70萬元)
2024年:首款干細胞藥物獲批,區塊鏈溯源系統全面應用
2025年:創新實施干細胞“醫療技術”分類管理,樂城試點突破收費限制

中國再生醫學SWOT分析
優勢:政策與市場雙輪驅動,技術突破形成局部優勢
中國再生醫學產業發展呈現政策與市場協同驅動的顯著特征。政策層面,"十四五"生物經濟發展規劃將再生醫學納入國家戰略性新興產業目錄,近三年中央及地方財政累計投入研發資金超85億元,形成持續穩定的創新激勵機制。市場層面,2022年行業規模已突破350億元人民幣,年復合增長率保持在28%以上,其中肌肉骨骼疾病應用等細分領域占據國內大市場份額。技術突破方面,中國在臨床級干細胞制備、生物墨水開發等領域已形成比較優勢,典型案例包括中國再生醫學(08158.HK)研發的全球首個生物工程角膜"艾欣瞳",該產品已覆蓋國內超千家醫院并進入東南亞、中東市場。
劣勢:產業鏈自主化不足與轉化效率瓶頸
產業短板主要集中在高端裝備依賴進口與技術轉化滯后兩大維度。上游關鍵設備中,高端生物反應器、超低溫存儲設備及核心培養基進口依賴度高達75%,形成產業鏈安全隱患。技術轉化層面,盡管中國依托豐富臨床資源實現從IND到NDA遞交的平均耗時(1,754天)快于美國(2,692天),但標準化生產體系缺失導致成本控制困難,且審評資源投入不足——中國每年新藥審評投入僅為美國的5.17%,專職審評人員數量差距顯著。以中國再生醫學為例,其軟骨修復膜等在研管線需超5年臨床試驗周期,2023年仍錄得1.8億港元虧損。
機會:老齡化與醫療升級催生千億市場
需求端呈現結構性增長態勢。人口老齡化加速推動退行性疾病治療需求,60歲以上人群骨關節疾病患病率已達45%,對應再生醫學產品滲透率每提升1%將釋放超50億元市場空間。慢性病高發形成剛性需求,僅骨關節炎患者已達6億人。支付體系改革成為重要催化劑,預計2027年細胞治療項目納入省級醫保目錄試點后,終端支付比例將從當前不足15%提升至30%以上。弗若斯特沙利文預測,中國再生醫學市場規模將從2025年的580億元增長至2030年的2,000億元,CAGR達23.6%。
威脅:國際競爭與技術封鎖雙重壓力
全球市場呈現地緣格局失衡特征,北美地區占據43%市場份額,歐洲占26.4%,跨國企業通過技術壟斷與渠道優勢構建競爭壁壘。強生、美敦力等企業在華加速布局,而諾華、羅氏等通過并購整合技術平臺,形成研發投入與專利布局優勢。潛在技術封鎖風險加劇產業不確定性,中國在核心材料與裝備領域的進口依賴可能面臨供應鏈中斷風險。國內競爭亦日趨激烈,昊海生科、正海生物等企業在細分領域的技術突破進一步壓縮市場空間。

核心矛盾解析:中國再生醫學產業正面臨"政策市場紅利與產業鏈短板并存"的發展悖論。28%的年復合增長率與85億元財政投入形成發展動能,但75%的高端設備進口依賴度和跨國企業43%的全球市場控制率構成現實約束,這種結構性矛盾將在未來5-8年決定產業全球競爭格局。
中國再生醫學未來趨勢
中國再生醫學正以“技術融合—產業化—國際化”為核心路徑加速發展,在多領域呈現突破性進展。技術融合層面,3D生物打印與基因編輯的交叉應用成為創新焦點。大阪大學開發的微型心臟模型展示了跨學科技術整合的潛力,而中國在該領域亦有顯著突破:天津大學研發的氧化鋅嵌合可注射水凝膠在骨關節炎治療中實現軟骨再生率超60%,華大基因的類器官芯片技術則推動精準醫療研究。基因編輯領域,CRISPR-Cas9技術的精準化改造使遺傳病治療特異性顯著提升,2023年全球相關臨床試驗數量同比增長38%,預計2025年后將迎來首批針對遺傳病和實體瘤的基因療法上市。
技術路線創新方面,中國在干細胞重編程領域形成獨特優勢。鄧宏魁團隊開發的化學重編程技術將人CiPS細胞誘導時間從30天縮短至10-16天,較日本iPS技術更具效率優勢,為個性化治療提供底層技術支撐。這種技術差異體現在再生醫學發展歷程中:

產業化進程中,自動化生產與CDMO平臺建設成效顯著。自動化封閉式細胞生產系統的普及使細胞制備成本從2018年的5萬美元/批次降至2023年的1.2萬美元,降幅達76%。中國CDMO平臺已占據全球28%的訂單份額,《“十四五”醫藥工業發展規劃》重點推動的超大規模(≥1萬升/罐)細胞培養技術,將進一步加速干細胞治療的規模化生產。預計到2030年,3D生物打印市場規模將達150億美元,干細胞存儲市場將從2025年的300億元增至800億元。
國際化布局呈現雙向拓展特征。中國與歐美、日韓等簽署10余項合作協議推進技術標準互認,中德聯合研發干細胞療法成為國際合作典范。同時,借助“一帶一路”倡議,中國再生醫學企業正加速開拓東盟等新興市場,目標將全球市場份額提升至15%。在技術引進方面,中國企業通過專利合作獲取前沿技術,如紐卡斯爾大學開發的Reji生物打印技術已在中國推進產業化落地,該技術可將細胞密度提升至傳統方法的10倍。
核心突破方向
技術融合:化學重編程與3D生物打印交叉應用,人CiPS細胞誘導時間短僅需10天
成本控制:通用型CAR-T療法通過基因編輯使生產成本下降60%,推動治療費用平民化
標準輸出:重組膠原蛋白等生物材料制定新行業標準,提升國際競爭力
未來五年,中國再生醫學將經歷從技術驗證向規模化商業應用的質變。隨著基因編輯精準度提升(新型堿基編輯技術脫靶率降至0.01%以下)和自動化生物反應器普及,行業集中度將持續提高,具有全產業鏈布局能力的企業將占據競爭制高點。預計到2030年,中國在全球再生醫學市場的占比將達到45%,成為推動行業發展的核心力量。
結論
中國再生醫學在政策支持、技術突破與市場需求驅動下已實現從"跟跑"向"并跑"跨越,但需突破材料進口依賴、臨床轉化瓶頸等挑戰。未來應通過持續優化醫保覆蓋與審批流程、突破核心材料產業化(如無血清培養基國產化率提升)、深化國際合作,推動行業標準化與商業化爆發,預計2026年前將出臺細胞治療商業化生產質量管理規范。作為萬億級戰略新興產業,其對"健康中國2030"具有核心價值,有望通過慢性病治療與器官移植領域突破,終實現從技術創新到產業引領的全球跨越。
核心發展路徑:政策優化(醫保覆蓋+審批加速)→技術突破(材料自主化)→國際合作→標準建立→萬億級產業集群。
Want to work with us?
